Решебник по химии 9 класс. Рудзитис ФГОС | Страница 24
Страница 24
Подумай, ответь, выполни
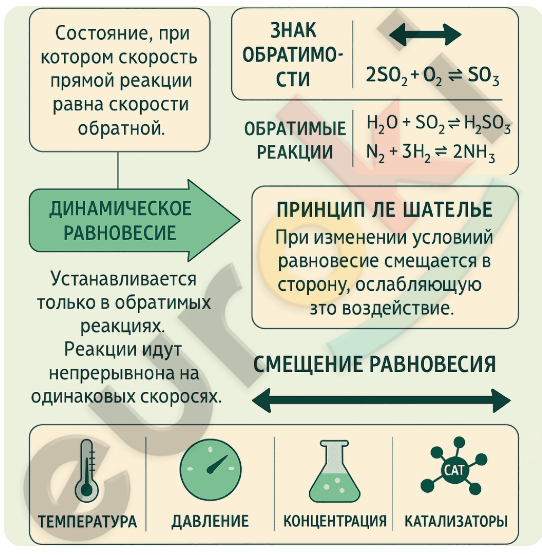
1. Составьте инфографику о состоянии химического равновесия.
Инфографика о химическом равновесии должна включать следующие ключевые элементы:
— Определение: Химическое равновесие — это состояние, при котором скорость прямой реакции равна скорости обратной.
— Условие: оно устанавливается в обратимых реакциях и является динамическим, то есть обе реакции продолжаются, но без изменения общего состава веществ.
— Примеры обратимых реакций:
(2SO₂ + O₂ ⇄ 2SO₃),
(H₂O + SO₂ ⇄ H₂SO₃),
(N₂ + 3H₂ ⇄ 2NH₃)
— Знак обратимости ⇄ используется вместо знака равенства.
— Правило Ле Шателье: при изменении внешних условий равновесие смещается в ту сторону, которая ослабляет это воздействие.
— Влияющие факторы: температура, давление, концентрация, катализаторы (ускоряют достижение равновесия, но не смещают его).
— Смещение равновесия в сторону продуктов или исходных веществ можно показать стрелками вправо или влево.
— Области применения: синтезы (аммиака, серной кислоты), металлургия, фармацевтика.
2. Определите, в каком направлении сместится равновесие а) при увеличении концентрации одного из исходных веществ, б) при повышении температуры; в) при понижении температуры — на примере следующих реакций:
а) (3O₂ ⇄ 2O₃ – Q)
б) (2H₂O ⇄ 2H₂ + O₂ – Q)
в) (C₃H₆ + H₂ ⇄ C₃H₈ + Q)
а) При увеличении концентрации кислорода (O₂) равновесие сместится вправо — в сторону образования озона (O₃), чтобы «израсходовать» добавленный реагент. При повышении температуры, так как реакция экзотермическая (–Q), равновесие сместится влево — в сторону поглощения тепла.
б) Повышение температуры также сместит равновесие влево — в сторону разложения воды, потому что реакция экзотермическая (–Q). Понижение температуры — вправо, в сторону образования воды.
в) Поскольку реакция сопровождается выделением теплоты (экзотермическая), при понижении температуры равновесие сместится вправо — в сторону образования пропана (C₃H₈), усиливая выделение тепла.
Таким образом, для экзотермических реакций повышение температуры смещает равновесие влево (в сторону реагентов), а понижение — вправо (в сторону продуктов).
3. Для какой химической реакции понижение температуры повлияет на смещение химического равновесия в сторону образования продуктов реакции?
а) (3O₂ ⇄ 2O₃ – Q)
б) (2H₂O ⇄ 2H₂ + O₂ – Q)
в) (C₃H₆ + H₂ ⇄ C₃H₈ + Q)
Понижение температуры смещает химическое равновесие в сторону экзотермической реакции, то есть туда, где происходит выделение теплоты (в сторону «+Q»).
Во всех трёх уравнениях продукты образуются с выделением теплоты (Q), то есть эти реакции — экзотермические. Значит, при понижении температуры равновесие сместится вправо — в сторону образования продуктов.
Поэтому правильный ответ — все три реакции соответствуют условию задания. Но если требуется выбрать одну, то самым очевидным примером является:
в) (C₃H₆ + H₂ ⇄ C₃H₈ + Q)
Ответ: в) — при понижении температуры равновесие смещается в сторону образования C₃H₈, то есть продуктов реакции.
4. Вычислите объём кислорода, необходимого для окисления 6,4 г оксида серы(IV).
Уравнение реакции: (2SO₂ + O₂ → 2SO₃)
Найдём количество вещества SO₂ по массе:
Mr(SO₂) = 32 + 2×16 = 64 г/моль
n(SO₂) = 6,4 г / 64 г/моль = 0,1 моль
По уравнению видно: 2 моль SO₂ реагирует с 1 моль O₂, значит, 0,1 моль SO₂ потребует 0,05 моль O₂
Найдём объём кислорода при нормальных условиях (1 моль газа = 22,4 л):
V(O₂) = 0,05 моль × 22,4 л/моль = 1,12 л
Ответ: для окисления 6,4 г SO₂ потребуется 1,12 л кислорода.






